Soluções de eletrólitos
Soluções de eletrólitos são especiaislíquidos, que estão parcial ou completamente na forma de partículas carregadas (íons). O próprio processo de dividir moléculas em partículas negativas (ânions) e carregadas positivamente (cátions) é chamado de dissociação eletrolítica. A dissociação em soluções só é possível devido à capacidade dos íons interagirem com moléculas do líquido polar, que atuam como solvente.
O que são eletrólitos

Soluções de eletrólitos dependendo do graudissociação pode ser dividida em forte, média e fraca. O grau de dissociação (α) é a razão entre o número de moléculas que se decompõem em partículas carregadas e o número total de moléculas. Em eletrólitos fortes, o valor de α aproxima-se 1, para médio α≈0,3 e para fraco α <0,1.
Os eletrólitos fortes geralmente incluem sais, alguns ácidos - HCl, HBr, HI, HNO3H2ASSIM4HClO4, hidróxidos de bário, estrôncio, cálcio e metais alcalinos. Outras bases e ácidos são eletrólitos médios ou fracos.
Propriedades de soluções de eletrólitos
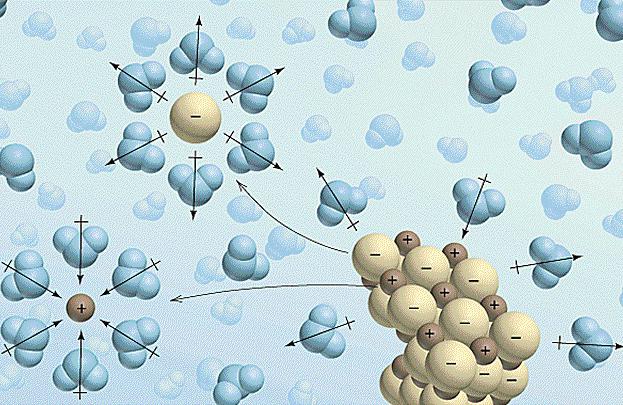
- A destruição de ligações intermoleculares e químicas do eletrólito dissolvido requer o gasto de certa quantidade de energia e, portanto, ocorre a absorção de calor (ΔHexp > 0).
- Nesta fase, o solvente começainteragir com os íons do eletrólito, resultando na formação de solvatos (em soluções aquosas - hidratos). Este processo é chamado de solvatação e é exotérmico, isto é, E. há uma liberação de calor (ΔHhidra <0).
- O último estágio é a difusão. Esta é uma distribuição uniforme de hidratos (solvatos) na solução a granel. Este processo requer custos de energia e, portanto, a solução é resfriada (ΔHdiff > 0).
Assim, o efeito térmico total da dissolução do eletrólito pode ser escrito desta forma:
ΔHraststv = ΔHexp + Δhidra + Δdiff
O sinal final do efeito térmico global da dissolução do eletrólito depende do que os efeitos energéticos constituintes se revelam. Geralmente esse processo é endotérmico.

Dependendo do dissolvidosubstâncias, todas as soluções de eletrólitos podem ser divididas em extremamente diluído (contendo apenas "traços" de eletrólito) diluído (com um pequeno teor de soluto) e concentrado (com um teor significativo de eletrólito).
Reações químicas em soluções de eletrólitos,que são causados pela passagem de uma corrente elétrica, levam à liberação de certas substâncias nos eletrodos. Esse fenômeno é chamado de eletrólise e é freqüentemente usado na indústria moderna. Em particular, graças à eletrólise, o alumínio, o hidrogênio, o cloro, o hidróxido de sódio, o peróxido de hidrogênio e muitas outras substâncias importantes são obtidos.


