Dissociação eletrolítica - como compreendê-lo?
Você nunca pensou em por que algunssoluções conduzem eletricidade e outras - não? Por exemplo, todo o mundo sabe que é melhor não tomar banho enquanto põe o cabelo com um secador de cabelo. Afinal de contas, a água é um bom condutor de corrente elétrica, e se um secador de cabelos funcionar na água, um curto-circuito não pode ser evitado. De fato, a água não é um bom condutor de corrente. Existem soluções que conduzem eletricidade muito melhor. Tais substâncias são chamadas eletrólitos. Estes incluem ácidos, álcalis e sais solúveis em água.
Eletrólitos - quem são eles?
A questão surge: por que soluções de algumas substâncias deixam a eletricidade passar e outras - não? É tudo sobre partículas carregadas - cátions e ânions. Quando dissolvidos em água, os eletrólitos se decompõem em íons, que se movem sob uma determinada direção na presença de uma corrente elétrica. Os cátions positivamente carregados se movem para o pólo negativo - o cátodo, e os ânions carregados negativamente se movem para o pólo positivo - o ânodo. O processo de decomposição da matéria em íons durante o derretimento ou dissolução na água tem um nome de orgulho - a dissociação eletrolítica.
Este termo foi posto em circulação pelo cientista sueco S.Arrhenius, quando estudou as propriedades das soluções para permitir a passagem da eletricidade. Para fazer isso, ele fechou o circuito elétrico através de uma solução de qualquer substância e observou a luz acender ou não. Se a lâmpada incandescente acender - a solução conduz eletricidade, o que implica que essa substância é um eletrólito. Se a lâmpada permanece extinta - então a solução não conduz eletricidade, daí esta substância - não-eletrólito. Não-eletrólitos incluem soluções de açúcar, álcool, glicose. Mas o sal de mesa rastorov, o ácido sulfúrico e o hidróxido de sódio conduzem perfeitamente a corrente elétrica, por isso são dissociação eletrolítica.
Como está a dissociação?
Posteriormente, a teoria da dissociação eletrolítica foi desenvolvida e complementada pelos cientistas russos IA. Kablukov e V.A. Kistyakovskii, aplicando à sua comprovação a teoria química de soluções de D.I. Universidade Mendeleev.
Esses cientistas descobriram que o eletrolíticoA dissociação de ácidos, álcalis e sais ocorre como resultado da hidratação do eletrólito, ou seja, sua interação com as moléculas de água. Os íons, cátions e ânions formados como resultado deste processo serão hidratados, isto é, conectados com moléculas de água, que os cercam com um anel denso. Suas propriedades são significativamente diferentes dos íons não hidratados.
Assim, na solução de nitrato de estrôncio Sr (NO3) 2, bem como em soluções de hidróxido de césio CsOH, ocorre a dissociação eletrolítica. Exemplos desse processo podem ser expressos pelas seguintes equações de reação:
Sr (NO3) 2 = Sr2 + + 2NO3 -,
ie. quando uma molécula de nitrato de estrôncio se dissocia, um cátion de estrôncio e dois ânions de nitrato são formados;
CsOH = Cs + OH-
ie. com a dissociação de uma molécula de hidróxido de césio formam-se um césio de césio e um anião de hidróxido.
A dissociação eletrolítica de ácidos ocorre de maneira semelhante. Para o ácido iodídrico, este processo pode ser expresso pela seguinte equação:
HJ = H + + CJ-
ie. quando uma molécula de ácido iodídrico se dissocia, um cátion de hidrogênio e um ânion de iodo são formados.
Mecanismo de dissociação.
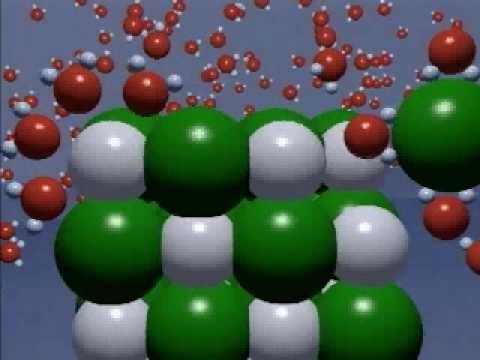
A dissociação eletrolítica de substâncias de eletrólito prossegue em várias etapas. Para substâncias com um tipo de ligação iônica, como NaCl, NaOH, este processo envolve três processos sucessivos:
Inicialmente, moléculas de água com 2 diferentes de moléculas de águapólos (positivo e negativo) e representando um dipolo, são orientados nos íons cristalinos. Eles anexam um pólo positivo ao íon negativo do cristal, e vice-versa, um pólo negativo ao íon positivo do cristal;
então a hidratação dos íons de cristal ocorre com dipolos de água,
e somente depois disso os íons hidratados parecem divergir em direções diferentes e começam a se mover na solução ou derreter caoticamente até que sejam afetados por um campo elétrico.
Para substâncias com ligação polar covalente, taiscomo o HCl e outros ácidos, o processo de dissociação é semelhante, exceto que no estágio inicial, a ligação covalente torna-se iônica devido à ação dos dipolos da água. Estes são os principais pontos da teoria da dissociação de substâncias.
</ ul </ p>