Tipos de redes de cristal de várias substâncias
Na natureza existem dois tipos de corpos sólidos quediferem significativamente em suas propriedades. Estes são corpos amorfos e cristalinos. E os corpos amorfos não têm um ponto de fusão exato, eles gradualmente amolecem durante o aquecimento e entram em um estado fluido. Um exemplo de tais substâncias é uma resina ou argila convencional. Mas a situação é completamente diferente com substâncias cristalinas. Eles permanecem em um estado sólido a uma certa temperatura, e somente depois de alcançá-lo, essas substâncias se fundem.
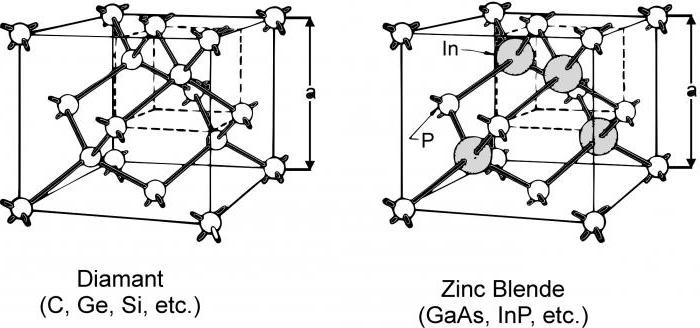
Aqui a coisa toda está na estrutura de tais substâncias. Em corpos cristalinos, as partículas das quais elas são compostas estão localizadas em certos pontos. E se você conectá-los com linhas retas, você obtém um quadro imaginário, que é chamado - a estrutura cristalina. E os tipos de redes cristalinas podem ser muito diferentes. E de acordo com o tipo de partículas a partir do qual elas são "construídas", as grades são divididas em quatro tipos. É uma rede iônica, atômica, molecular e metálica.
E nos locais de redes de cristais iônicos,portanto, os íons estão localizados e existe um vínculo iônico entre eles. Esses íons podem ser simples (Cl-, Na +) ou complexos (OH-, SO2-). E esses tipos de redes cristalinas podem conter alguns hidróxidos e óxidos metálicos, sais e outras substâncias similares. Tome, por exemplo, cloreto de sódio normal. Alterna íons negativos de cloro e íons positivos de sódio, que formam uma rede cristalina cúbica. As ligações iônicas em tal rede são muito estáveis e as substâncias "construídas" por este princípio têm bastante força e dureza.
Existem também tipos de redes de cristal,chamado atômico. Aqui nos nós há átomos, entre os quais há uma forte ligação covalente. A rede atômica não tem tantas substâncias. Estes incluem diamante, bem como germânio cristalino, silício e boro. Existem ainda algumas substâncias complexas que contêm óxido de silício e possuem, respectivamente, uma rede cristalina atômica. É areia, quartzo, cristal de rocha e sílica. E na maioria dos casos tais substâncias são muito fortes, sólidas e refratárias. Eles também são praticamente insolúveis.
E os tipos moleculares de redes de cristal têmas mais diversas substâncias. Estes incluem água congelada, isto é, gelo vulgar, "gelo seco" - monóxido de carbono solidificado, bem como sulfureto de hidrogénio sólido e cloreto de hidrogénio. No entanto, as redes moleculares possuem muitos compostos orgânicos sólidos. Estes incluem açúcar, glicose, naftaleno e outras substâncias similares. E as moléculas que estão nos nós de tal rede estão conectadas umas às outras por ligações químicas polares e não polares. E apesar do fato de que dentro das moléculas entre os átomos há fortes ligações covalentes, essas moléculas são mantidas na rede devido a ligações intermoleculares muito fracas. Portanto, tais substâncias são suficientemente voláteis, facilmente fundem e não possuem uma grande dureza.
Bem e metais têm os mais diferentes tiposgrades de cristal. E em seus nós podem ser átomos e íons. Ao mesmo tempo, os átomos podem ser facilmente convertidos em íons, dando aos seus elétrons "uso comum". Da mesma forma, íons, "capturando" um elétron livre, podem se tornar átomos. E tal estrutura da estrutura cristalina de metal determina tais propriedades dos metais como plasticidade, ductilidade, calor e condutividade elétrica.
Também tipos de redes de cristal de metais, eoutras substâncias, dividem-se em sete sistemas básicos na forma de jaulas de rede elementares. O mais simples é uma célula cúbica. Também existem células unitárias rômbicas, tetragonais, hexagonais, romboédricas, monoclínicas e triclínicas, que determinam a forma de toda a rede cristalina. Mas na maioria dos casos, as redes cristalinas são mais complexas do que as listadas acima. Isso se deve ao fato de que as partículas elementares podem estar localizadas não apenas nos próprios locais da rede, mas também no seu centro ou em suas faces. Entre os metais, os mais comuns são três redes cristalinas complexas: cúbicas centradas no rosto, centradas no corpo cúbicas e hexagonais fechadas. Mesmo as características físicas dos metais dependem não apenas da forma da rede cristalina, mas também da distância interatômica e de outros parâmetros.