A reação do composto. Exemplos de Reação Composta
Muitos processos sem os quais é impossívelPara representar a nossa vida (como respiração, digestão, fotossíntese e afins) estão associados a várias reações químicas de compostos orgânicos (e inorgânicos). Vamos dar uma olhada nos seus principais tipos e entraremos em mais detalhes sobre o processo chamado conexão (conexão).
O que é chamado de reação química
Em primeiro lugar, vale a pena dar uma definição geral destafenômeno. Pela frase em consideração, várias reações de substâncias de diferentes complexidades são entendidas, resultando em diferentes produtos formados a partir dos produtos iniciais. As substâncias envolvidas neste processo são referidas como "reagentes".

Na carta, a reação química do orgânicocompostos (e inorgânicos) é escrito usando equações especializadas. Externamente, eles nos lembram um pouco dos exemplos matemáticos de adição. No entanto, a seta ("→" ou "⇆") é usada em vez do sinal ("="). Além disso, às vezes pode haver mais substâncias no lado direito da equação do que na esquerda. Tudo o que há antes da flecha são substâncias antes do início da reação (o lado esquerdo da fórmula). Tudo o que está depois (lado direito) - os compostos formados como resultado do processo químico que ocorreu.
Como exemplo de uma equação química, pode-se considerar a reação de decomposição de água em hidrogênio e oxigênio sob a ação de uma corrente elétrica: 2H2О → 2H2↑ + Sobre2↑. A água é o reagente de partida e o oxigênio com o hidrogênio é um produto.
Como mais um, mas mais complexoUm exemplo da reação química dos compostos pode ser considerado um fenômeno familiar a todas as hostess que pelo menos uma vez assaram doces. É uma questão de extinguir o bicarbonato de sódio com a ajuda do vinagre de mesa. A ação é ilustrada pela seguinte equação: NaHCO3 +2 СН3COOH → 2 CH3COONa + CO2↑ + H2A. É claro a partir disso que o sal de sódio de ácido acético, água e dióxido de carbono se forma durante a interação de hidrogenocarbonato de sódio e vinagre.
Por sua natureza, os processos químicos ocupam um lugar intermediário entre o físico e o nuclear.
Ao contrário do primeiro, participando de produtos químicosAs reacções do composto são capazes de alterar a sua composição. Isto é, a partir dos átomos de uma substância, vários outros podem ser formados, como na equação acima mencionada para a decomposição da água.
Ao contrário das reações nucleares, as reações químicas não afetam os núcleos de átomos de substâncias interativas.
Quais são os tipos de processos químicos?
A distribuição das reações dos compostos por espécie ocorre de acordo com diferentes critérios:

- Reversibilidade / irreversibilidade.
- Presença / ausência de agentes e processos catalisadores.
- Na absorção / liberação de calor (reação endotérmica / exotérmica).
- Pelo número de fases: homogêneas / heterogêneas e duas variedades híbridas delas.
- Variando os graus de oxidação de substâncias que interagem.
Tipos de processos químicos em química inorgânica pelo método de interação
Este critério é especial. Com sua ajuda, quatro tipos de reações são distinguidos: composto, substituição, decomposição (clivagem) e troca.

O nome de cada um deles corresponde ao processo,que ela descreve. Ou seja, no composto as substâncias são combinadas, em substituição - elas são transformadas em outros grupos, vários deles formam-se na decomposição de um reagente e, na troca, os participantes da reação variam entre si pelos átomos.
Tipos de processos pelo método de interação em química orgânica
Apesar da grande complexidade, as reações de compostos orgânicos ocorrem no mesmo princípio que as inorgânicas. No entanto, eles têm vários nomes distintos.
Assim, os compostos e reações de decomposição são chamados"Adição", bem como "separação" (eliminação) e decomposição diretamente orgânica (nesta seção de química existem dois tipos de processos de clivagem).
Outras reações de compostos orgânicos sãosubstituição (nome não muda), reagrupamento (troca) e processos de oxidação-redução. Apesar da similaridade de seus mecanismos, em orgânicos eles são mais versáteis.
A reação química do composto
Tendo considerado vários tipos de processos envolvendo substâncias em química orgânica e inorgânica, vale a pena refletir com mais detalhes precisamente sobre a conexão.
Esta reação difere de todas as outras em que, independentemente da quantidade de reagentes em seu início, no final todos eles se combinam em um.
Como exemplo, podemos lembrar o processo de resfriamento da cal: CaO + H2O → Ca (OH)2. Neste caso, a reação do compostoóxido de cálcio (cal viva) com óxido de hidrogênio (água). Como resultado, o hidróxido de cálcio (cal apagada) é formado e vapor quente é liberado. Aliás, isso significa que esse processo é realmente exotérmico.
A equação da reação do composto
Esquematicamente, o processo em consideração é possívelda seguinte forma: A + BV → ABC. Nessa fórmula, ABC é uma substância complexa recém-formada, A é um reagente simples e BV é uma variante de um composto complexo.

Deve-se notar que esta fórmula também é característica do processo de adição e conexão.
Exemplos da reação em questão são a interação de óxido de sódio e dióxido de carbono (NaO2 + CO2↑ (t 450-550 ° C) → Na2CO3), e também óxido de enxofre com oxigênio (2SO2 + O2↑ → 2SO3).
Além disso, vários compostos compostos são capazes de reagir uns com os outros: AB + VH → ABHG. Por exemplo, todos o mesmo óxido de sódio e óxido de hidrogênio: NaO2 + H20 → 2NaOH.
Condições para a reação em compostos inorgânicos
Como foi mostrado na equação anterior, substâncias de diferentes graus de complexidade podem entrar na interação em consideração.

Neste caso, para reagentes simples de origem inorgânica, são possíveis reações de oxidação-redução do composto (A + B → AB).
Como exemplo, podemos considerar o processo de obtenção de cloreto férrico. Para isso, é realizada a reação do composto entre o cloro e o ferum (ferro): 3Cl2↑ + 2Fe → 2FeCl3.
No caso de interação de substâncias inorgânicas complexas (AB + VG → ABHG), os processos nelas podem ocorrer, afetando e não afetando sua valência.
Para ilustrar isso, deve-se considerar o exemplo da formação de hidrogenocarbonato de cálcio a partir de dióxido de carbono, óxido de hidrógeno (água) e corante alimentício branco E170 (carbonato de cálcio): CO2↑ + H2O + CaCO3 → Ca (CO3)2. Neste caso, a reação clássica do composto ocorre. Quando é realizado, a valência dos reagentes não se altera.
Uma equação química ligeiramente mais perfeita (que a primeira) 2FeCl2 + Cl2↑ → 2FeCl3 É um exemplo de interaces redox com gás simples e complexo inorgânico reagentes (cloro) e sais (cloreto de ferro).
Tipos de reações de adição em química orgânica
Como já indicado no quarto parágrafo, emsubstâncias de origem orgânica, a reação em questão é referida como "afiliação". Como regra, envolve substâncias complexas com uma ligação dupla (ou tripla).

Por exemplo, a reação entre dibromo e etileno, levando à formação de 1,2-dibromoetano: (C2H4) CH2= CH2 + Br2 → (C₂H₄Br₂) BrCH2 - CH2Fr. By the way, sinais semelhantes para igual e negativo ("=" e "-"), nesta equação mostram as conexões entre os átomos de uma substância complexa. Esta é uma característica de escrever fórmulas de substâncias orgânicas.
Dependendo de quais dos compostos atuam como reagentes, diversas variedades do processo de fixação são diferenciadas:
- Hidrogenação (adicione as moléculas de hidrogênio H em uma ligação múltipla).
- Hidrohalogenação (halogeneto de hidrogênio é anexado).
- Halogenação (adição de halogéneos Br2, Cl2↑ e similares).
- Polimerização (formação de vários compostos de baixo peso molecular de substâncias com alto peso molecular).
Exemplos da reação de adição (composto)
Depois de listar as variedades do processo em consideração, vale a pena aprender na prática alguns exemplos da reação do composto.
Como uma ilustração da hidrogenação, podemos prestar atenção à equação de interação do propeno com o hidrogênio, como resultado do qual o propano surgirá: (C3H6↑) CH3-CH = CH2↑ + H2↑ → (C3H8↑) CH3-CH2-CH3↑.
Em química orgânica, a reação do composto (adição) pode ocorrer entre ácido clorídrico (substância inorgânica) e etileno com a formação de cloroetano: (C2H4↑) CH2= CH2↑ + HCl → CH3- CH2-Cl (C2H5Cl). A equação apresentada é um exemplo de hidrohalogenação.
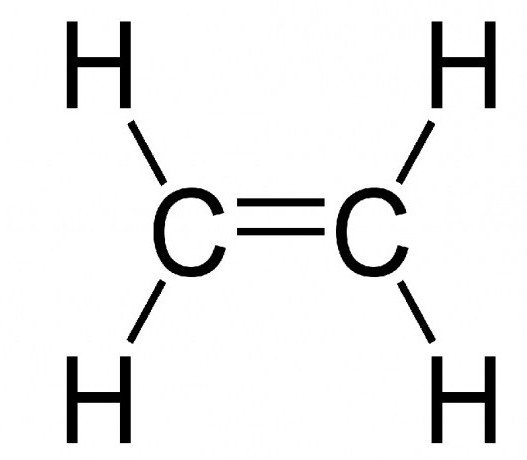
Com relação à halogenação, pode ser ilustrada pela reação entre dicloro e etileno levando à formação de 1,2-dicloroetano: (C2H4↑) CH2= CH2 + Cl2↑ → (C₂H₄Cl₂) ClCH2-CH2Cl.
Muitas substâncias úteis são formadasgraças à química orgânica. A reação do composto (ligação) de moléculas de etileno com o radical iniciador de polimerização sob a influência de ultravioleta é confirmada por este: n CH2 = CH2 (Luz R e UV) → (-CH2-CH2-) n. A substância formada deste modo é bem conhecida por todas as pessoas sob o nome de polietileno.

Deste material são feitos tipos diferentesembalagens, sacos, utensílios, tubos, substâncias isolantes e muito mais. Uma característica desta substância é a possibilidade de sua reciclagem. Sua popularidade polietileno devido ao fato de que ele não se decompõe, por causa de que os ambientalistas negativamente o consideram. No entanto, nos últimos anos, um método para descarte seguro de produtos de polietileno foi encontrado. Para isso, o material é tratado com ácido nítrico (HNO3). Depois disso, certos tipos de bactérias são capazes de decompor essa substância em componentes inofensivos.
A reação do composto (adição) desempenha um papel importantepapel na natureza e na vida humana. Além disso, é freqüentemente usado por cientistas em laboratórios para sintetizar novas substâncias para vários estudos importantes.




