Fórmula estrutural e molecular: acetileno
Características da estrutura do acetileno afetam suas propriedades, produção e aplicação. A designação convencional da substância - C2H2 É a sua fórmula mais simples e bruta. O acetileno é formado por dois átomos de carbono, entre os quais há uma ligação tripla. Sua presença reflete diferentes tipos de fórmulas e modelos da molécula de etileno, permitindo compreender o problema da influência da estrutura nas propriedades da matéria.
Alcinos. A fórmula geral. Acetileno
Hidrocarbonetos alquílicos, ou acetileno, sãoacíclico, insaturado. A cadeia de átomos de carbono não está fechada, existem ligações simples e múltiplas nela. A composição de alcinos reflete a fórmula sumária CnH2n - 2. Nas moléculas de substâncias desta classe háuma ou mais ligações triplas. Compostos de acetileno referem-se a compostos insaturados. Isso significa que apenas uma valência de carbono é realizada devido ao hidrogênio. As três ligações restantes são usadas quando interagindo com outros átomos de carbono.
O primeiro - e o representante mais famosoalcinos-acetileno, ou etino. O nome trivial da substância vem da palavra latina "acetum" - "vinagre" e grego - "hyle" - "árvore". O fundador da série homóloga foi descoberto em 1836 em experimentos químicos, posteriormente a substância foi sintetizada a partir de carvão e hidrogênio por E. Davy e M. Bertlo (1862). À temperatura normal e pressão atmosférica normal, o acetileno está em estado gasoso. É um gás incolor, inodoro, ligeiramente solúvel em água. A etin é mais facilmente solúvel em etanol e acetona.

Fórmula Molecular do Acetileno
Etin - o membro mais simples de sua série homóloga, sua composição e estrutura refletem as fórmulas:
- C2H2 - registro molecular da composição do etano, que dáa noção de que uma substância é formada por dois átomos de carbono e o mesmo número de átomos de hidrogênio. De acordo com esta fórmula, as massas moleculares e molares do composto podem ser calculadas. Mr (De2H2) = 26 a. e. m., M (C2H2) = 26,04 g / mol.
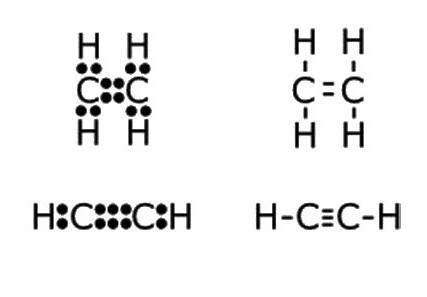
- Н: С ::: С: Н - a fórmula eletrônica do acetileno. Imagens semelhantes, chamadas "estruturas de Lewis", refletem a estrutura eletrônica da molécula. Ao escrever, é necessário observar as regras: o átomo de hidrogênio tende a ter a configuração da camada de valência do hélio na formação de uma ligação química, os outros elementos - por um octeto de elétrons externos. Cada cólon significa um comum para os dois átomos ou um par não compartilhado de elétrons do nível de energia externo.
- H-C≡C-H é a fórmula estrutural do acetileno, que reflete a ordem e a multiplicidade das ligações entre os átomos. Um traço substitui um par de elétrons.

Modelos da molécula de acetileno
Fórmulas mostrando a distribuição de elétrons,serviu como base para a criação de modelos orbitais atômicos, fórmulas espaciais de moléculas (estereoquímica). Já no final do século XVIII, os modelos de barras esféricas se tornaram difundidos - por exemplo, bolas de diferentes cores e tamanhos, designando carbono e hidrogênio, que formam o acetileno. A fórmula estrutural de uma molécula é representada na forma de bastonetes, que simbolizam as ligações químicas e seu número em cada átomo.

O modelo esférico de acetileno reproduzângulos de valência iguais a 180 °, mas as distâncias internucleares na molécula são refletidas aproximadamente. Os vazios entre as bolas não criam uma imagem do preenchimento do espaço dos átomos com densidade eletrônica. A desvantagem é eliminada nos modelos de Driding, que designam os núcleos de átomos não com bolas, mas com os pontos de fixação das hastes uns aos outros. Modelos volumétricos modernos dão uma ideia mais vívida dos orbitais atômicos e moleculares.
Orbitais atômicos híbridos de acetileno
O carbono no estado excitado contém três orbitais p e um s com elétrons não pareados. Na formação de metano (CH4) eles tomam parte na criação de equivalentesligações com átomos de hidrogênio. O famoso pesquisador americano L. Pauling desenvolveu a teoria do estado híbrido dos orbitais atômicos (AO). A explicação do comportamento do carbono em reações químicas é o alinhamento da AO em forma e energia, a formação de novas nuvens. Orbitais híbridos dão conexões mais fortes, a fórmula se torna mais estável.
Átomos de carbono na molécula de acetileno, em contraste commetano, sofrem sp-hibridação. Os elétrons S e p são misturados em forma e energia. Aparecem dois orbitais, posicionados em um ângulo de 180 °, dirigidos em lados opostos do núcleo.

Conexão tripla
Em acetileno híbrido eletrônico nuvens de carbonoparticipar na criação de ligações σ com os mesmos átomos vizinhos e com hidrogênio em pares CH. Permanecem dois orbitais p não híbridos perpendiculares entre si. Na molécula de etileno, eles participam da formação de duas ligações π. Juntamente com σ existe uma ligação tripla, que reflete a fórmula estrutural. O acetileno difere do etano e do etileno pela distância entre os átomos. A ligação tripla é mais curta que a dupla, mas tem uma maior reserva de energia, é mais sólida. A densidade máxima das ligações σ e π está localizada em regiões perpendiculares, o que leva à formação de uma nuvem eletrônica cilíndrica.
Características da ligação química em acetileno
A molécula de etileno tem uma forma linear, que é bem sucedidareflete a fórmula química do acetileno - H-C≡C-H. Os átomos de carbono e hidrogênio estão ao longo de uma linha reta, entre eles existem 3 σ e 2 π-ligações. Livre circulação, rotação ao longo do eixo C-C é impossível, isso é impedido pela presença de múltiplas ligações. Outras características da ligação tripla:
- o número de pares de elétrons conectando dois átomos de carbono é 3;
- comprimento - 0,120 nm;
- A energia de ruptura é de 836 kJ / mol.
Para efeitos de comparação: nas moléculas de etano e comprimento único de etileno e uma ligação química duplo - 1,54 e 1,34 nm, respectivamente, o intervalo de energia C-C é de 348 kJ / mol, C = C - 614 kJ / mol.
Homólogos do acetileno
O acetileno é o mais simples representante de alcinos, cujas moléculas também têm uma ligação tripla. Propyn CH3С≡СН - homólogo de acetileno. Fórmula do terceiro representante de alcinos - butyne-1 - CH3CH2С≡СН. O acetileno é o nome trivial do etano. A nomenclatura sistemática de alcinos está sujeita às regras da IUPAC:
- em moléculas lineares, o nome da cadeia principal, que surge do número grego, é adicionado ao qual o sufixo -in e o número do átomo são adicionados com uma ligação tripla, por exemplo, etino, propino, butin-1;
- a numeração da cadeia principal de átomos começa no final da molécula mais próxima da ligação tripla;
- para hidrocarbonetos ramificados, o nome do ramo lateral é seguido pela primeira vez, seguido pelo nome da cadeia principal de átomos com o sufixo -in.
- a parte final do nome - uma figura indicando a localização da ligação tripla na molécula, por exemplo, butyn-2.

Isomerismo de alcinos. Dependência de propriedades na estrutura
Etina e propino não têm isômeros do triploeles aparecem, começando com Butin. Os isómeros do esqueleto de carbono estão na pentina e nos seguintes homólogos. O isomerismo espacial dos hidrocarbonetos acetilênicos não se manifesta em relação à ligação tripla.
Os primeiros 4 homólogos de etanol são gases que são pouco solúveis em água. Hidrocarbonetos de acetileno C5 - C15 - líquido. Os sólidos são homólogos de etano, começando com hidrocarbonetos C17. A natureza química dos alcinos sofreuma influência significativa da ligação tripla. Hidrocarbonetos deste tipo são mais ativos que o etileno, e várias partículas estão ligadas. Esta propriedade é baseada no uso generalizado de etano na indústria e engenharia. Ao queimar acetileno, uma grande quantidade de calor é liberada, o que encontra aplicação no corte a gás e na soldagem de metais.