Ligação do doador-aceitador: exemplos de substâncias
A ligação do doador-receptor, ou coordenação, é um tipo de ligação covalente. Nós revelamos as características distintivas deste tipo de conexão, daremos exemplos que demonstram sua formação.

Ligação covalente
Para começar, distinguimos as características distintivas da própria ligação química covalente.
Pode ser polar e não polar, emdependendo da posição do par de elétrons entre os átomos. Se um deslocamento parcial da densidade eletrônica ocorre em direção a um dos átomos, ocorre uma ligação química polar covalente. Um fenômeno semelhante é possível com a formação de uma ligação entre não-metais com eletronegatividade diferente. Quando aumenta, ocorre um deslocamento significativo do par de elétrons em direção ao átomo com um grande expoente de EO. Quando uma ligação é formada entre não-metais tendo o mesmo valor de eletronegatividade, não há mudança de um par de elétrons, tal conexão é chamada não-polar.
Exemplos são oxigênio, hidrogênio, ozônio, fósforo. A conexão polar é ácido clorídrico, água, amônia.
Existe um termo especial pelo qual se pode caracterizar o número de pares de elétrons formados entre os átomos.
Considerando que para a formação de um vínculorequer dois elétrons, haverá três ligações entre os átomos de nitrogênio, ou seja, a multiplicidade corresponde a três. A ligação doador-aceitador é um caso especial de uma ligação polar covalente, mas a interação intermolecular de substâncias é assumida.

Recursos do mecanismo
Para formar uma ligação covalente convencionalinteração suficiente entre dois elétrons (par comum). A ligação química doador-receptor é formada como resultado de um par de elétrons de um lado (do doador), um orbital não preenchido (livre) de outro átomo (aceptor). No caso de uma ligação polar covalente (não polar) e na interação doador-receptor, os elétrons eventualmente se tornam comuns.

Formação de cátions de amônio
Como se forma a ligação doador-receptor? Exemplos de substâncias dadas no decorrer da química do ensino secundário são limitadas ao cátion amônio. Vamos analisar sua educação em mais detalhes.
Nitrogênio, que faz parte da molécula de amônia,está no quinto grupo (o subgrupo principal) da tabela periódica. Em seu nível de energia externo, existem cinco elétrons. Quando uma molécula de amônia é formada em uma ligação polar covalente, o nitrogênio gasta três elétrons, então um par de elétrons que não participa de tal processo permanece sem uso.
É ela quem lhe dá o direito de manifestar as propriedades do doador quando as moléculas de amônia se juntam aos dipolos da água. Na água, o cátion de hidrogênio não tem seus próprios elétrons, então exibe as propriedades do aceptor.
No momento em que as moléculas de amônia estão nosuficientemente próximo dos prótons de hidrogênio da água, uma nuvem de nitrogênio que consiste de dois elétrons aparece na esfera de atração do cátion de hidrogênio, torna-se comum a eles. Como resultado, a formação de uma ligação tetravalente entre o nitrogênio e o hidrogênio ocorre, um mecanismo doador-aceitador é assumido. Isso, como dizem, é um exemplo clássico de formação de comunicação.
Formação de cátions oxônio
No currículo escolar (nível básico), nãoconsiderando cação oxonium (hydronium) como soluções teoria protolytic estudados somente no nível do perfil. Uma vez que também é usado vínculo doador-receptor, exemplos de sua formação um olhar mais atento.
Como um doador, neste caso, vai agirmolécula de água, e o próton manifesta as propriedades do receptor. O mecanismo considerado doador-aceitador é o que é chamado a base da química de compostos complexos e, portanto, merece atenção especial. Ele explica a essência da teoria da decomposição eletrolítica de ácidos, sais, bases quando dissolvidos em água em cátions e ânions.
Quando tal ocorre devido passagem de permeação de electrões ligado no invólucro exterior de átomos que podem ser ligadas. Assim, um aumento no número de electrões nas camadas externas para uma.

O segundo algoritmo de formação de comunicação
Existe outro mecanismo pelo qualligação do doador-aceitador. Exemplos de tais interacções são numerosos, em particular a formação de fluoretos metálicos. O uso de um par de elétrons de um dos átomos reagentes é observado. Como resultado, um átomo completa sua concha ao máximo, mas nem todos os oito elétrons participam da conexão, apenas uma certa parte deles. Esses elétrons que não tomam parte na conexão são chamados de livres e, com a ajuda dos outros, é criada uma ligação doadora-aceitadora. Exemplos de tal variante de ligação doador-aceitador referem-se à formação de fluoretos de metais alcalinos e alcalino-terrosos. Por exemplo, sódio, potássio, fluoreto de cálcio é similarmente preparado.
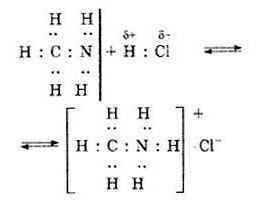
Qual é a diferença entre um vínculo doador-aceitador? É possível destacar compostos estáveis que surgem devido a um mecanismo semelhante para a formação de compostos químicos. Por exemplo, a dissolução do fluoreto de hidrogênio na água, a conexão entre amônia e cloreto de alumínio, levando à formação de compostos complexos.

Conclusão
Tendo em conta as regras do doador-aceitadorinteração, notamos que os gases inertes podem atuar como doadores ativos, uma vez que eles têm o número máximo de elétrons na camada externa. Experimentalmente, tal afirmação foi totalmente confirmada, e óxidos de gases inertes formados precisamente pela interação doador-aceitador foram revelados.
Este tipo de ligação covalente tem um especialvalor na vida de uma pessoa. Além da participação ativa em sua vida, graças à comunicação do doador-receptor, é possível criar produtos alimentícios, várias preparações farmacêuticas. Por exemplo, o mecanismo de formação de cátions de amônio considerado acima diz respeito à formação de amônia, que é amplamente utilizada na medicina moderna.